항균 감수성 테스트
Unknown bacteria identification
박테리아의 동정과 병원균의 탐지를 포함하여 정확한 미생물의 확인은 미생물의 감염과 관련된 질병의 발생에 정확한 진단, 감염 치료 및 추적에 필수적이다. 동정은 대상 미생물의 종을 판별하여 어떠한 특성이 있고 어디에 속하는지 알아내는 것이다. 검사에서 이미 알아낸 특징과 함께 추가적인 실험을 하여 대상의 특징을 알아내는데 생화학적 검사, 면역학적 검사, 유전자 검사 등이 있다. 동정을 하는 방법으로는 morphological methods, genetic methods, biochemical methods, physiological methods, serological methods가 있다.
먼저 morphological methods(형태학적 방법)는 크게 3가지가 있다. 먼저 크기에 따른 동정이다. 박테리아는 물리적 크기에 따라 식별할 수 있다. 그 다음은 모양을 기반으로 한 동정이다. 박테리아의 구조는 구형(cocus), 막대 모양(bacilli)과 사슬 모양(strepto), comma 모양 등 다양하다. 또한 영양 배지에서 성장한 박테리아가 형성한 colony의 모양 조차도 박테리아의 종류에 따라 다르다. 마지막으로 extra-cellular characters이다. 이 방법은 몇가지 세포외 특징을 이용하여 박테리아를 동정한다. 일부 박테리아는 움직임에 따라서 박테리아 표면에 편모를 가지고 있다. 따라서 박테리아 표면에 편모의 수와 편모의 배열을 기준으로 확인할 수 있다. 이 3가지 방법을 통해서 형태학적으로 균을 동정할 수 있다.
그 다음은 genetic methods(유전학적 방법)이다. 유전적 방법에서 대표적인 것이 16s rRNA sequencing이다. 균의 리보솜은 두개의 소단위로 구성되어 있는다. 리보솜을 구성하는 RNA를 rRNA라고 하는데 이 RNA의 서열을 비교하여 균을 동정할 수 있다. 이 RNA의 서열은 대부분 상당히 보존되어 있는 한편 일부 구간에서는 높은 염기서열 다양성이 나타난다. 특히 동종간에는 다양성이 거의 없는 반면에 타종간에는 다양성이 나타나므로 생물동정에 사용된다. 16s rRNA 유전자 염기서열사이에 유전학적으로 차이를 나타내지 않을 수 있기 때문에 정확한 동정을 위해서는 세균의 표현형적 결과도 확인해야 한다. 16s rRNA sequencing은 순수배양된 단일 colony를 사용하여 DNA를 분리하여 PCR 증폭을 하여 관찰한다.
biochemical methods(생화학적 방법)는 다양한 방법이 있다. 그중에 가장 대표적인 방법은 Oxidase와 Catalase를 이용한 방법이다. Oxidase test는 균의 Oxidase 생성 여부를 알아보는 시험으로 음성 반응을 나타내는 장내세균들을 걸러내고 양성 반응을 나타내는 Neisseria, Alkaligenes, Aeromonas, Vibrio와 Pseudomonas 등을 찾아내는데 이용한다. Catalase test는 Cytochrome을 가지고 있는 대부분의 편성 혐기성, 호기성 세균은 자기 보호를 위해 Catalase를 생산하여 대사과정 중 생기는 유해물질인 H₂O₂를 분해할 수 있다. 그러므로 H₂O₂를 떨어뜨려 Catalase를 생성하는 균을 동정할 수 있다.
physiological methods(생리학적 방법)의 대표적인 방법은 Simmon’s citrate test이다. 어떤 세균은 ammonium phosphate를 질소원으로, citrate를 탄소원으로 하여 성장한다. 이런 세균은 배지 내의 질소원인 ammonia 염을 분해하여 암모니아(NH3)가 생성되게 하는데, 이것이 배지를 알칼리화 시킨다. 배지 내 들어있는 지시약인 BTB는 pH가 6.0 이하면 노란색, 7.6 이상이면 짙은 푸른색을 나타내는 지시약이다. 이를 통해 ammonium phosphate를 질소원으로 하는 균을 동정할 수 있다. 또 다른 방법은 sugar fermentation test이다. 이 실험은 세균의 당 발효 여부를 알아보는 시험으로 당을 발효할 경우 배지의 pH가 낮아지며 이는 배지 내 첨가된 지시약에 의해 구분할 수 있다. 즉 세균이 배지 내의 당을 이용하여 발효하면 떨어지는 pH에 의해 배지 내 지시약인 BCP에 의해 색이 변한다. BCP는 pH가 6.3 이상이면 보라색, 5.2 이하면 노란색을 나타낸다. 양성 반응은 배지가 노란색을 보이며 이는 세균이 첨가된 당을 발효하였음을 보여준다.
마지막으로 serological methods(혈청학적 방법)이다. 이 방법은 박테리아의 동정에서 의심되는 박테리아에 특이적인 항체와 항원을 사용한다.
Antimicrobial Susceptibility Test(AST)
항생제 감수성 검사는 균체가 가지는 항생제에 대한 내성의 유무와 그 정도를 알아보는 시험으로 간단하며, 적절한 항생제를 적당량 투여할 수 있도록 검사하는 방법이다. 항생제 감수성 검사는 균종에 따라 달라진다. 검사 방법은 Broth dilution, DISC diffusion, E-test가 있다. 항생제 감수성 검사는 세계적으로 규격화 되었는데 균의 농도는 McFarland 0.5, 즉 1.5×10^8 CFU/㎖를 사용하고 배지는 주로 공통 배양이 가능한 배지, MHB(Mueller-Hinton Broth) 또는 MHA(Mueller-Hinton Agar)를 사용한다. 또한 결과값은 CLSI에서 제시하는 규격에 따라 해석한다. 항생제 감수성 검가의 해석 기준은 최소억제농도(MIC, Minimum Inhibitory Concentration)를 기초로 한다. 최소억제농도는 배양된 균의 육안적 증식을 억제할 수 있는 항생제의 가장 낮은 농도를 뜻한다. 또한 최소치사농도(MBC, Minimum Bactericidal Concentration)는 균을 죽일 수 있는 가장 낮은 농도를 말한다.
이번 실험에서 우리는 균주로 S. aureus라고 생각되는 균주를 사용했다. Broth dilution은 96 well plate를 사용하여 항생제의 농도를 희석해가며 MIC와 MBC를 알 수 있는 검사 방법이다. 시험 항균제를 2배수로 희석한 후, 일정량의 균주를 접종한다. 그 다음 배양 후 균의 증식이 관찰되지 않는 항균제의 농도를 MIC로 한다. 실험에서 사용한 항생제는 Oxacillin과 Chloramphenicol을 사용하였다. 실험 방법은 96 well plate의 1번 well line에 200㎕의 항생제를 분배한다. 2~12번 well line은 MHB를 100㎕씩 분배한다. A line은 positive control, B line은 negative control을 위해 사용하고 C~E line은 Oxacillin을 사용하고 F~H line은 Chloramphenicol을 사용한다. Oxacillin은 200㎍/㎖의 농도로 투여하고 Chloramphenicol은 500㎍/㎖로 투여한 다음 1번 well부터 순차적으로 100㎕씩 옮겨 항생제의 농도를 2배수로 희석한다. 마지막 12번 well에서 100㎕를 버려 모든 well이 100㎕가 되도록 맞춘다. 마지막으로 모든 well에 100㎕의 균을 접종하다. 이때 균의 접종 후 농도는 5×10^5 CFU/㎖가 되어야 한다. 그 이유는 균의 증식을 육안으로 판별할 수 있어야 하기 때문이다. 100㎕의 항생제와 100㎕의 10^6 농도의 균을 섞어 200㎕의 5×10^5 농도를 맞춘다. 24시간 배양한 다음 MIC를 측정하고 MIC로 측정된 부분부터 이후를 모두 분리하여 배양한 다음 균의 증식 유무의 판별로 MBC를 측정한다.

결과로 4-1 96well plate와 4-2 96well plate 모두 Oxacillin에 대한 S. aureus의 증식이 10번 well부터 관찰이 되었다. 그리고 Chloramphenicol의 증식은 7번 well에서부터 관찰이 되었다. 이결과를 바탕으로 CLSI에서 제시한 규격을 해석해보면 Oxacillin 항생제에 대한 S. aureus의 항생제 감수성은 9번 well에서 항생제 농도 0.39㎍/㎖로 매우 감수성이 있는 것으로 나타났다. 또한 Chloramphenicol 항생제에 대한 감수성은 6번 well에서 항생제 농도 7.81㎍/㎖로, 이 또한 감수성을 나타내는 것을 알 수 있었다. 그에 따라 Oxacillin의 MIC는 9번 well이고 Chloramphenicol의 MIC는 6번 well이다. 그 다음은 MBC를 측정 하기 위해서 Oxacillin의 1번부터 9번까지 well에서 5㎕ 씩 분리하여 배양했고, Chloramphenicol은 1번부터 6번까지 well에서 분리하여 배양했다.

배양한 결과 Oxacillin의 MBC는 8번 well인 농도 0.78㎍/㎖인 것으로 나타났다. 그리고 Chloramphenicol은 1번부터 6번까지 모든 well에서 균의 증식이 확인되어 MBC의 값을 측정할 수 없었다. 실험 결과의 이유로 Oxacillin은 항생제를 희석하는 과정이나 균을 접종하는 과정에서 실수가 있어 결과 값이 상당히 떨어지게 나온 것 같다고 생각한다. 또한 MBC를 측정하는 과정에서 오염이 존재하였으나 객관적으로 판단하였을 때 8번 well이 MBC가 맞다는 결론을 내렸다.
DISC diffusion은 Kirby-Bauer 항생제 검사 또는 agar diffusion이라고도 한다. 기초배지로 MHA(Mueller-Hinton Agar)를 사용한다. Agar의 표면에 loop로 고르게 접종하고, 그 위에 항균제 디스크를 놓는다. 배양한 다음 균이 성장하지 못한 반경의 지름을 측정한다. 이 실험에서 사용한 항생제는 4종류로 Oxacillin, tetracycline, gentamicin, Chloramphenicol을 사용했다. 실험 방법은 OD600의 0.1인 1×10^8 CFU/㎖의 농도인 균을 배지에 균일하게 바르고 디스크를 놓았다. 그 다음 배양을 하고 균이 자라지 못한 지름을 측정한다. 측정 결과, Oxacillin의 지름은 20.5mm, tetracycline은 26mm, gentamicin은 20mm, 그리고 Chloramphenicol은 24mm로 측정 되었다. 이 결과를 바탕으로 CLSI에서 제시한 규격을 해석해보면 Oxacillin은 약한 저항성을 갖고 Oxacillin을 제외한 나머지 3개의 항생제에는 감수성을 갖는다고 판단할 수 있다.
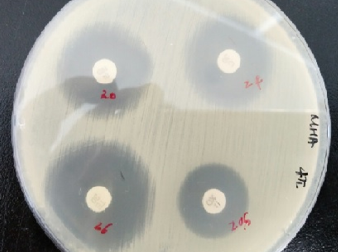
E-test는 실험실에서 MIC를 측정하기 위해 사용하는 실험이다. E-test는 다양한 박테리아나 곰팡이에 대한 광범위한 항균제의 정확한 MIC 값을 결정할 수 있다. Plate에 항생제가 묻어 있는 E-test 스트립을 떨어트려 측정한다. 실험 방법은 실험 방법은 OD600의 0.1인 1×〖10〗^8 CFU/㎖의 농도인 S. aureus를 배지에 균일하게 바르고 Oxacillin이 묻어 있는 스트립을 놓았다. 그리고 하루동안 배양한 다음 균이 자라지 못한 부분의 최소 농도를 측정한다.

실험 결과로 항생제 농도 0.38㎍/㎖에서 MIC가 측정 되었다. 이것은 앞서 실험한 Broth dilution과 비슷한 결과 나온 것으로 판별하여 S. aureus의 Oxacillin에 대한 항생제 감수성은 MIC, 항생제 농도 0.38㎍/㎖가 맞다고 생각된다.
마지막으로 우리는 우리가 S. aureus를 규격화 되어있는 균의 농도인 McFarland 0.5, 즉 1.5×10^8 CFU/㎖를 사용하지 않고 OD600의 0.1인 1×10^8 CFU/㎖의 농도를 사용 하였기 때문에 평판계수법(plate culture method)을 사용하여 우리가 사용한 균의 정확한 수를 측정해 보고자 하였다. 균을 10배 희석해서 희석을 6번 반복한다. Square plate에 10㎕씩 각각 희석용액을 떨어트려 준다. 시료가 희석된 용액을 흡수한 Square plate를 하루동안 배양한다. 그 다음 형성된 colony의 개수를 측정하고 최소 균의 CFU를 계산한다. 1/10^5 희석한 용액에서 19개의 colony가 형성되었고 그에 따라 10㎕에 1.9×10^6 CFU를 형성 하고 1㎖에서 1.9×10^8 CFU/㎖ 이라는 것을 계산할 수 있었다.
Antibiotic resistance mechanisms of bacteria
항생제는 살아있는 유기물에서 추출한 것으로 다른 미생물의 생장을 억제하거나 죽이는 물질을 말한다. 항생제의 내성이란 세균이 항생제로부터 스스로를 방어하기 위해 만들어낸 자체 방어능력으로, 세균은 DNA 변이를 통하여 다음에 그 항생제를 또 만났을 때 견뎌낼 수 있는 기전을 발전시키다. 세균에게는 항생제를 만들 수 있는 능력과 그 항생제에 대항할 수 있는 능력이 동시에 있다. 즉, 항생제 내성은 세균에 없던 능력이 성질이 새로이 생기는 것이 아니라 이미 있던 성질이 활성화 된 것이다. 원래 항생제가 투여되기 전에는 이 항생제에 저항성을 갖고 있는 균주와 항생제에 의해 치명적인 타격을 받을 수 있는 감수성 균주가 차이가 나지 않는다. 그러나 일단 항생제가 사용되기 시작하면, 자연스럽게 감수성 균주는 사멸하고 저항성을 가진 균주만 남게 된다.
세균이 항생제에 가지는 내성은 크게 자연 내성과 획득 내성이 있다. 자연 내성은 자연돌연변이 또는 적응 변이주에 의한 내성의 획득 방법이고 획득 내성은 교차내성 또는 유전자 전달에 의해 내성이 생기는 방법이다. 세균이 항생제에 저항하는 내성이 생기는 기작을 살펴보면, 세균이 항생제를 배출해 세균 밖으로 내보내거나 수용체인 세균이 항생제 부착부위의 모양을 바뀌 결합을 막는 방법, 균에서 분해효소를 발생해 항생제를 녹여내거나, 세포막을 두껍게 하여 항생제의 침입을 막는 방법으로 내성을 가지게 된다.
항생제가 향균효과를 발휘하는데 필수적인 조건을 고려하면 이에 대한 세균의 내성 획득 기작을 이해할 수 있다. 항생제가 세균에 대하여 작용하기 위해서는 다음의 조건들이 충족되어야 한다. 첫째, 세균의 세포 내에 항생제의 표적분자가 있고, 적절한 농도의 항생제가 세포내의 표적이 되는 부위로 침투가 가능하여야 하며, 둘째, 항생제가 표적분자와 만나 상호작용을 통하여 항균효과를 발휘할 수 있어야하고, 셋째, 항생제가 세균의 세포내 혹은 세포외의 효소에 의하여 불활성화 되는 것을 피하여야 한다. 이러한 전제 조건을 충족하면서 각 항생제는 서로 다른 기작을 통하여 항균효과를 나타내고 있다. 항생제가 항균효과를 나타내는 기작은 크게 다섯가지로 요약할 수 있다. 세균의 세포벽 합성의 억제, 단백질 합성의 억제, 핵산합성 및 활성의 억제, 엽산 등 세균 대사의 방해, 세포막 기능과 구조의 변형 등이다.

박테리아의 자연 내성은 고유의 구조적 혹은 기능적 특징에 근거해 항생제 효과에 저항하는 능력이다. 각 종에서 박테리아의 항생제 내성은 크게 4가지로 분류할 수 있다. 먼저, 가장 간단한 내성으로, 특정 항생제에 민감한 표적을 제거하는 것이다. 즉, 항생제가 작용하기 위해 결합하는 표적물질을 변화시켜 항생제의 작용점이 없어지게 되어 내성을 획득하는 방법이다. 생물 유해물질인 트리클로산(triclosan)은 그람양성 박테리아와 많은 그람음성 박테리아에 효과적이나, 그람음성 종인 슈도모나스(peudomonas) 속의 박테리아 성장을 억제할 수는 없다. 두 번째 예는 β-lactam계 항생제인 페니실린이나 세파계 항생제가 결합하는 PBP를 변형시켜 항생제가 작용하지 못하게 하는 내성균이 있다. 변성된 PBP가 생성되면 페니실린에 대한 내성을 갖게 된다. 대표적인 사례가 S. aureus의 변형된 PBP에 의한 Methicillin 내성이다.
둘째는 세균이 항생제를 불활성화시키는 효소를 만드는 것이다. 항생제가 세포 내에 침투하여 표적 분자와 상호 작용을 하고, 균체 내에 축적이 되면 항균효과를 발휘할 수 있게 된다. 이 단계에 세균은 항생제에 대항하게 위하여 항생제를 불활성화시키는 효소 등을 생산하여 내성을 나타내기도 한다. β-lactamase가 대표적이다.
셋째로 항생제가 세균을 공격하는 첫 번째 단계인 침투과정에서 세포막의 항생제 투과성을 변화시키는 것이다. 세균의 세포외막에는 영양물질을 받아들이고 대사산물을 내보내는 통로(Porin)가 있으며 여기를 통하여 황생제가 세포 안으로 들어가는데 이 통로를 소실, 변화시켜 항생제가 들어오지 못하게 막아 내성을 나타낸다. 그람양성 종과 비교하면, 그람음성 박테리아는 태생적으로 외막에 투과 장벽을 만들기 때문에 많은 항생제들이 투과되기 어렵다. Porin을 감소 감소시키거나 더욱 선택적인 채널들로 대체함으로써 외막의 투과성을 감소시키고, 박테리아 내 항생제 유입을 제한할 수 있다. 마지막으로 세포 내로 들어온 항생제를 세포밖으로 퍼내는 유출(efflux) 기작에 의한 내성 발현은 Tetracycline 제제가 대표적인 예이며, 세포내 항생제 축적의 방해 예는 Aminoglycoside가 있다. 세균은 이러한 몇 가지 방법들 중 한 가지 혹은 두 가지 이상을 이용하여 효과적으로 항생제에 대항한다.

Selective media & differential media from classes
LPM agar는 구연산 나트륨과 iron ammonium glycosides를 첨가함으로써 Listeria의 선택적 배지로 사용된다.
PALCAM agar는 Listeria spp.의 분리에 사용하기 위해 사용하는 선택 및 분별 배지이다. PALCAM 배지는 식품에서 Listeria monocytogenes의 검출에 사용하기 위해 APHA 및 AFNOR에 의해 권장되고 우유 및 유제품에서 Listeria spp.의 검출을 위한 추가 도금 매체로서 International Dairy Federation에 의해 권장된다. 매체의 선택성은 lithium chloride, polymyxin B sulfate, acriflavine-HCl, 및 ceftazidime이 있으며, 이는 대부분의 Listeria spp.가 아닌 균종의 성장을 억제한다. Mannitol과 pH 지시약인 phenol red가 이 종의 Mannitol 발효 균주를 Listeria spp.와 구별하기 위해 첨가되었다. Mannitol 발효는 산 생산으로 인해 적색에서 황색으로 변하는 색의 변화로 나타난다.
Oxford agar 또한 Listeria의 선택적 배지로 사용된다. Listeria spp.의 높은 내염성은 장구균의 성장을 현저히 억제하는 수단으로 사용됩니다.
Bolton broth는 Campylobacter spp.에 사용되는 배지이다. 여러 종류의 Campylobacter spp.는 내열성 및 미세 내공성이 있다. 또한 최대 42ºC의 온도에서 계속 최적으로 자랄 수 있고 산소가 감소 된 환경에서 사는 것을 선호한다. 내열성과 감염성 Campylobacter spp.의 가장 일반적인 균주는 Campylobacter jejuni와 Campylobacter coli이다. 항생제인 vancomycin, cefoperazone 및 trimethoprim은 그람 양성균과 그람 음성균의 생장을 억제하고 Cycloheximide는 효모 및 곰팡이의 성장을 크게 억제한다. 마지막으로, 초기 배양 단계 후 41.5 ℃의 인큐베이션 온도는 Bolton broth의 선택성을 증가시켜 감염성 Campylobacter spp. 종의 존재를 보다 쉽게 검출 할 수 있게 한다.
mCCDA agar는 Campylobacter spp.를 검출하는데 사용되는 선택 배지다.
CT-SMAC agar는 E. coli serotype 0157:H7을 선택적 분별하는데 사용하는 배지이다. SMAC의 감도는 같이 있는 미생물 군집에서 non-sorbitol-fermenting colony를 구분하는데 어려움이 있다. CT-SMAC agar에서 일반적으로 O157:H7 혈청형은 무색 colony를 형성하고 다른 대장균은 적색 colony를 생성합니다. 오랜 시간 동안 배양하면 sorbitol-fermenting colony가 감소하고 O157:H7 혈청형의 colony가 감소 할 수 있다.
Fluorocult E. coli O157 agar는 E. coli serotype 0157:H7을 선택하는데 사용하는 배지이다. Fluorocult E. coli O157 agar에 들어있는 Sodium deoxycholate는 그람 양성균의 성장을 억제 한다. sorbitol은 pH 지시약인 bromothymol blue와 함께 sorbitol 양성 미생물의 경우 colony가 노란색으로 변하는 sorbitol 분해를 결정합니다. 반대로, sorbitol 음성 균주는 배양 배지의 색을 변화시키지 않아서 녹색의 colony로 번식한다.
Rappaport - Vassiliadis Salmonella(RVS) 배지는 적절한 배지에서 표본을 미리 농축 한 후 Salmonella spp.의 농축에 사용되는 선택 배지이다. 배지의 선택도는 malachite green의 존재와, 높은 삼투압 및 낮은 pH로 인한 것이다. 고농도의 염화 마그네슘은 삼투압을 상승시키고 malachite green과 함께 Salmonella spp. 이외의 박테리아를 억제합니다. 배지의 pH가 낮으면 장내 박테리아를 포함한 균을 억제하여 선택성을 증가시킨다.
Tetrathionate(TT) Broth는 Salmonella spp. 이외의 그람 양성균 및 그람 음성균에 대한 억제성 담즙산 염을 함유하고 있다. Iodine-Iodide 용액은 접종 직전에 준비된 배지에 첨가 한다. Iodine-Iodide 용액의 첨가는 분변 표본의 정상 장내 균을 억제하는 tetrathionate의 생산을 촉진시킨다.
Xylose lysine deoxycholate agar (XLD agar)는 Salmonella와 Shigella spp.를 분리하는데 사용 하는 선택적 성장 배지이다. 약 7.4의pH를 가지며 지시약 phenol red로 인해 밝은 핑크색 또는 적색으로 남는다. 당 발효는 pH를 낮추고 지시약 phenol red는 노란색으로 바뀌게 된다. Salmonella를 포함한 대부분의 소화관 박테리아는 sugar xylose를 발효시켜 산을 생산할 수 있습니다. 하지만 Shigella spp.는 이것을 할 수 없으므로 빨간색으로 보인다.
Hektoen agar는 Hektoen enteric(HE) agar라고 하고 Salmonella 와 Shigella를 선별하는데 주로 사용되는 선택배지 이면서 선별배지 이다. HE agar에는 3가지 탄수화물과 2가지 지시약 염료가 들어있다. 높은 담즙산 농도는 모든 Gram positive bacteria의 증식을 억제하고 또한 대장균의 증식을 억제한다. 지시약시료에 의해 Salmonella는 청녹색으로 colony를 형성한다.
bismuth sulfite agar는 salmonella spp.를 분리하는데 주로 사용되는 선택 배지이다. Bismuth는 Gram positive bacteria의 증식을 막고, ferrous sulfate를 이용하는 능력과 hydrogen sulfide로 전환하는 능력을 이용한다.
Rambach agar는 salmonella spp.를 분리하는데 주로 사용되는 배지이다. 다른 색을 착색하는 배지에 비해서 읽기 쉬운 강렬한 적색을 나타낸다. Sodium desoxycholate는 다른 그람 양성균의 성장을 억제한다.
EMJH(Ellinghausen-McCullough-Johnson-Harris) medium은 ammonium chloride, 질소원 및 성장 인자인 thiamine을 함유하고 있다. Sodium phosphate 및 potassium phosphate는 완충제로 사용된다. Sodium chloride은 이 배지의 삼투압 균형을 유지하는데 사용된다. Leptospira Enrichment EMJH는 albumin, polysorbate 80 및 Leptospira의 성장을 위한 추가적인 성장 인자를 함유하고 있다.
'생명과학' 카테고리의 다른 글
| 원유 및 발효유의 세균 수 측정 ( Spreading & Pouring ) (0) | 2020.08.11 |
|---|---|
| 유과학 : 비중(specific gravity), 산도(Titratable acidity), pH 측정 실험 (0) | 2020.08.11 |
| RNA-seq data analysis (RNA_seq 데이터 분석 실험) (2) | 2020.08.09 |
| 세포 내 RNA를 연구하는 방법 (0) | 2020.08.09 |
| 진핵 세포에서의 전사!!! 전사(transcription)에 관한 모든것 (3) (2) | 2020.08.09 |




댓글